品牌
生产厂家厂商性质
衡水市所在地
1





双塔串联式脱硫脱硝设备
脱硫脱硝双塔串联式独立处理设备的的设计、制造、施工、安装、调试、实验试运行及验收,交付用户。符合环境治理要求以及新版的ISO标准,达到和当地环保规定的锅炉大气排放标准;
《污水综合排放标准》(GB211627-2008)
《工业企业厂界噪声标准》(GB12348-2008)
《工业企业设计卫生标准》(GBZ1-2002)
《混凝土结构设计规范》和1993年局部修订(GBJ10-2002)
《钢结构设计规范》(GB50010-200)
《建筑地基基础设计规范》(GB50007-2002)
《低压配电装置规范》(GBJ54-83)
SON脱硫脱硝除尘系统布置满足系统整体布置要求;
确保SON脱硫脱硝除尘系统不影响原煤燃烧气炉的正常运行;
SON脱硫脱硝除尘装置使用寿命长、操作维护简单,布置紧凑、占地面积小; 在满足系统各项指标的前提下,尽可能降低工程投资和运行成本。
双塔串联式脱硫脱硝技术
(1)双塔中脱硫工艺采用镁法脱硫技术,脱硝采用氧化法脱硝技术,除尘采用双膜微电除尘技术。
(2)本装置中的核心设备脱销塔、脱硫塔中的喷淋层及防边际效应圈为我公司技术,提高脱销、脱硫效率的同时降低喷淋雾群对吸收塔塔壁的冲刷;每层喷淋喷嘴经过详细布置和CFD流场模拟,可使脱硫塔断面上实现均匀的喷淋效果,以达到脱销、脱硫*效果;我公司设计的喷淋层,平时只运行一层就可以达到效果,设置第二层为备用,减少运行费用,以备排放更低时的需要。
(3)双塔设备年运行小时按2880h考虑;
(4)双塔装置运行率不小于98%,装置服务寿命为12年以上;
(5)设计保证脱硫装置的烟气处理能力为工况时75%~110%的烟气量,设计保证值为吸收塔出口二氧化硫浓度、氮氧化物浓度、尘等排放物达标排放。
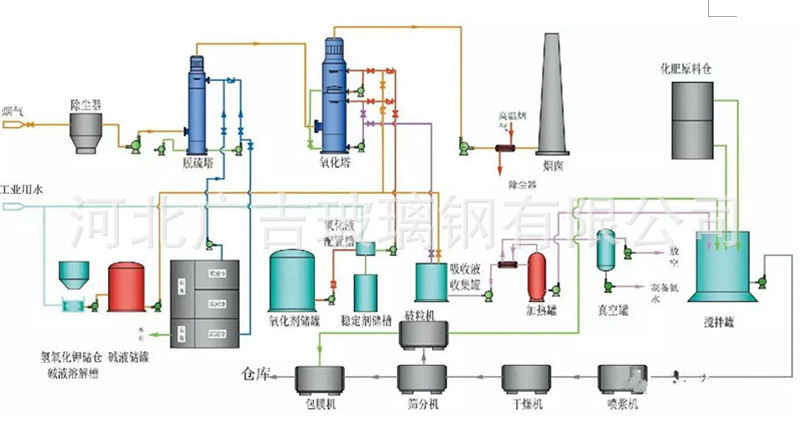
图2 脱硫浆液处理工艺流程简图


1.设计必须符合适用的要求:选择的处理工艺、构筑物(建筑物)型式、主要设备、设计标准和数据等,应zui大限度地满足使用的需要,以保证烟气脱硫系统功能的实现。在充分尊重用户需求和环境保护管理部门意见的同时,认真执行有关法规、标准及规定。
2.设计应符合经济的要求:选择的处理工艺应能满足系统需要和要求,并尽可能降低运行费用。设计中一方面尽可能选用质优价廉的设备,以及采用合理措施降低工程造价;另一方面又必须保证在工程建成投入使用后,取得zui大的经济效益和使用效果。
3.技术应当力求*、合理:设计中必须根据生产的需要和可能,在经济合理的原则下,尽可能采用*技术。在机械化、自动化与仪表化程度方面,要从实际出发,根据需要和可能及设备的供应情况,妥善确定。
4.实用、美观,避免二次污染:平面布置和建、构筑物形式力求与厂区其它建筑和环境协调*。整个系统设计应充分考虑设备噪声、处理药剂等可能造成的二次污染。
5.不影响煅烧炉正常运行:脱硫脱硝除尘系统工作时不影响煅烧炉的正常运行,并保证在给定设计条件下,确保烟气中污染物达标排放。装置使用寿命长、操作维护简单,布置紧凑、占地面积小。处理设施有较高的耐冲击负荷能力,并能在寒冷气候条件下正常运行。
双塔串联式脱硫脱硝工艺原理
镁法脱硫工艺原理
镁法脱硫工艺是镁的碱性氧化物与水反应生成氢氧化物,再与二氧化硫溶于水生成的亚硫酸溶液进行酸碱中和反应,氧化镁反应生成的亚*和*,亚*氧化后生成*。脱硫过程中发生的主要化学反应有
MgO+H2O→Mg(OH)2
Mg(OH)2+SO2→MgSO3+H2O
MgSO3+H2O+SO2→Mg(HSO3)2
2MgSO3+O2→2MgSO4
镁法脱硫副产物为*,本方案回收采用七水*的精制工艺得到工业级七水*。
脱硫浆液处理工艺原理
先对脱硫浆液进行氧化,使脱硫产物亚*氧化为*。反应方程式如下:
然后去除*溶液中的杂质,*稀溶液再进入蒸发器加热室,利用外加动力进行循环,有效增加对流传热系数,减少换热面积。运行过程中即使溶液有晶体析出,系统也能正常使用,不易结垢。冷凝器采用间接冷凝,二次蒸汽冷凝为液态后可返回其他系统再利用。冷却结晶器降低溶液温度,同时溶解度下降,在特定温度条件下溶液中析出七水*晶体,经离心机分离后,可得到七水*晶体。化学反应方程式为:
3脱硝原理
脱硝采用氧化法脱硝技术,烟气中NOx的氧化度低时,用碱液吸收NOx的吸收效率不高。为提高吸收效率,先用氧化剂先将NOx中的部分NO氧化,以提高NOx的氧化度后,再用碱液吸收。氧化剂有O2、O3、Cl2等气相氧化剂和HNO3、KMnO4、NaClO2、NaClO、H2O2、KBrO3、K2Cr2O7等液相氧化剂。采用*氧化、碱吸收时,在碱性溶液中NO与NaClO2的反应如下:
NaClO2 →Na++ClO2-
2NO+ClO2-→2NO2+Cl-
NO+ClO2- →NO2+ClO-
4NO2+ClO2-+4OH- →4NO3-+Cl-+2H2O
2NO2+ClO2-+2OH- →2NO3-+ClO-+2H2O
因为生成了HNO3,溶液pH值在短时间内迅速下降,而NaClO2在酸性溶液中会分解,其反应过程如下:
ClO2-+H+ →HClO2
8HClO2→6ClO2+Cl2+4H2O
2ClO2-+Cl2 →2Cl-+ClO2
4ClO2-+2H+→ 2ClO2+ClO3-+Cl-+2H2O
NO的氧化反应如下:
4NO+3ClO2-+2H2O →4HNO3+3Cl-
5NO+4HCl →4ClO2+5Cl-+2H2O
5NO+3ClO2+4H2O →5HNO3+Cl-
反应生成的氮氧化物被*吸收:




